na2o与水反应 na2o加水生成什么
重要反应必练
写出下列反应的化学方程式,是离子反应的再写出离子方程式。
①切开的钠,钠表面的现象及反应:
4Na+O2→2Na2O(银白色褪去)
②钠放在坩埚里加热:受热后先熔化,发出黄色火焰,生成淡黄色固体
2Na+O2→△→Na2O2(先熔化成小球,黄色火焰,生成淡黄色固体)
③Na和H2O的反应:
2Na+2H2O→2NaOH+H2↑
2Na+2H2O→2Na++2OH-+H2↑
④Na和乙醇的反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
⑤呼吸面具中Na2O2的反应:
2Na2O2+2H2O→4NaOH+O2↑
2Na2O2+2H2O→4Na++4OH-+O2↑
2Na2O2+2CO2→2Na2CO3+O2
⑥Na2O与水反应Na2O+H2O→2NaOH
Na2O+H2O→2Na++OH-
⑦Na投入硫酸铜溶液中2Na+CuSO4+2H2O→Cu(OH)2+H2↑+Na2SO4
⑧钠与氯化铵溶液反应的气体产物H2、NH3
⑨NaH与水反应NaH+H2O→NaOH+H2↑
NaH+H2O→Na++OH-+H2↑
实验现象强化记忆
①钠和滴有酚酞的水反应的实验现象(五个字):游动,变红
②钠和乙醇反应的实验现象:钠沉浮,产生气泡
③钠和氯气的实验现象:燃烧,产生白烟
④Na在盛有水和煤油的烧杯中反应的现象:上下跳动
⑤将一小块Na放入FeCl3溶液中,有什么现象?生成红褐色沉淀
⑥将水滴入用脱脂棉包住的Na2O2中,有什么现象?剧烈燃烧
知识网络构建
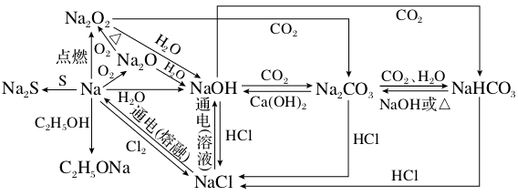
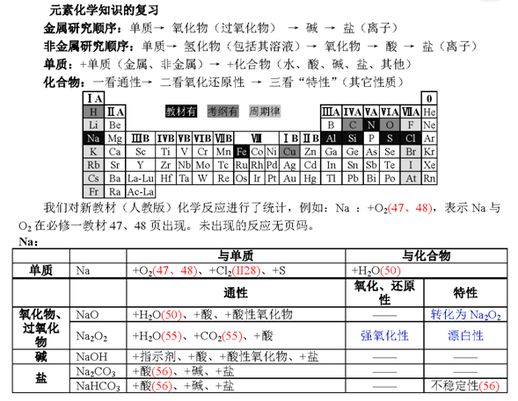
元素化合物复习思路
答案:
①银白色褪去 4Na+O2=2Na2O
②在坩埚里受热后先熔化,发出黄色火焰,生成淡黄色固体
2Na+O2 ==△=Na2O2
③2Na+2H2O===2NaOH+H2↑ 2Na+2H2O===2Na++2OH-+H2↑
④2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
⑤2Na2O2+2H2O===4NaOH+O2↑ 2Na2O2+2H2O===4Na++4OH-+O2↑
2Na2O2+2CO2===2Na2CO3+O2
⑥Na2O+H2O=2NaOH Na2O+H2O=2Na++OH-
⑦2Na+CuSO4+2H2O=Cu(OH)2+H2↑+Na2SO4
⑧H2、NH3
⑨NaH+H2O===NaOH+H2↑ NaH+H2O===Na++OH-+H2↑
3.①Na浮在水面上,四处游动,发出"嘶嘶"的响声,并熔化成光亮的小球,最后小球完全消失,滴入酚酞试液,立即变红
②钠沉在乙醇液面下,钠块表面有气泡产生,反应不如钠与水反应剧烈
③钠在氯气中燃烧,发出黄色火焰,产生大量白烟
④Na在水和煤油的分界处上下跳动,并有少量气泡冒出,直至完全消失
⑤Na浮在液面上,四处游动,发生"嘶嘶"的响声,并熔化成光亮的小球,最后完全消失,并观察到有红褐色沉淀生成
⑥脱脂棉剧烈燃烧
附:他山之石:每周记背
一、化学科学
1. 化学是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的重要的自然科学。
注意:制备新的原子不是化学变化。
2.化学的特征:是认识分子和制造分子。
3.化学是以实验为基础的科学,化学具有实用性和创造性。
4.现在化学家们已经能够在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器。
5.重要的化学史
波义耳——提出化学元素的概念;
拉瓦锡——建立燃烧现象的氧化学说;道尔顿——提出了原子学说;
门捷列夫——发现了元素周期律;
我国化学家——结晶牛胰岛素和核糖核酸。
二、钠及其重要的化合物
1.研究物质性质的方法
观察、实验、分类、比较
2.钠的物理性质
银白色固体、质软、熔点低、密度比水小,具有良好的导电、导热性。
3.钠的化学性质
(1)2Na+2H2O=2NaOH+H2↑
(现象:浮、熔、游、响、红)
(2)4Na+O2=2Na2O(白色)
(3)2Na+O2=△=Na2O2(先熔化成小球,黄色火焰,生成淡黄色固体)
注意:钠与氧气反应因反应条件的不同而产物不同。
(4)2Na+2HCl=2NaCl+H2↑
反应规律:钠直接与酸溶液发生置换反应。
(5)2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
总式2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑(蓝色沉淀,无色气体)
