氯化铵的电子式 NH4Cl电子式
氮元素
位置:元素周期表中第二周期第ⅤA族。
结构:
- 最外层5个电子。
- 不容易失电子,可得到3个电子成为稳定结构。
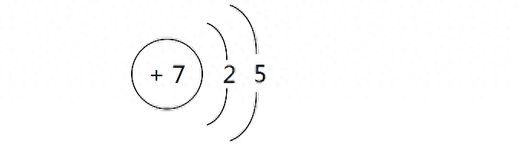
性质:
- 一般通过形成共价键与其他原子结合。
存在形式:
游离态:
- 以氮气分子的形式存在于空气中,约占空气体积的78%。
化合态:
- 植物和动物体内的蛋白质中。
- 土壤和海洋中的硝酸盐和铵盐中,如硝酸钾和硫酸铵。
氮元素是构成蛋白质的必须元素,是自然界各种生物生命活动不可缺少的重要元素,农业生产中必须大量使用氮肥。
氮气的性质:
氮气是一种无色无味的气体,不溶于水,是空气的主要成分。其性质稳定,通常很难与其他物质发生化学反应。这是由于其分子的三键结构,需要较多的能量才能断裂。

氮气的化合价变化:
- 与金属反应时作氧化剂,表现出氧化性。
- 与氧气反应时作还原剂,表现出还原性。
氮的固定:
- 自然固氮:雷电、豆科植物的根瘤菌。
- 人工固氮:利用氢气将氮气合成氨。
氮化合物的化合价:
- 除了-3、0价外,还有+1、+2、+3、+4、+5价等。
- 均存在对应的氧化物。
氧化物重要性:
- 一氧化氮(NO)、二氧化氮(NO2)。
- NO和NO2的物理性质。
NO和NO2的化学性质:
- NO被氧气氧化生成NO2。
- NO2溶于水发生氧化还原反应。
收集一氧化氮和二氧化氮气体的方法:
- 一氧化氮:排水法。
- 二氧化氮:排空气法。
实验:一氧化氮、二氧化氮、氧气和水之间的反应
现象:
- 吸入一氧化氮和水后,无明显现象。
- 吸入空气后,无色气体变为红棕色。
- 再振荡,红棕色气体逐渐变为无色,气体体积缩小。
结论:
- NO不溶于水,不与水反应,但与氧气反应生成NO2。
- NO2与水反应生成NO,体积减小。
启示:
- 可以采取增大NO2与水的接触面积、降低温度等措施将NO充分转化为硝酸。
- 为工业上生产硝酸提供参考。
理论上,我们可以通过持续通入过量空气,实现氮氧化物完全转化为硝酸。其反应机理如下:
一氧化氮 (NO) 被氧化成二氧化氮 (NO2):
2NO + O2 = 2NO2
随后,二氧化氮 (NO2) 溶于水生成硝酸 (HNO3):
3NO2 + H2O = 2HNO3 + NO
上述反应中产生的 NO 可以循环回第一步反应,继续被氧化成 NO2。理论上来说,只要氧气供应充足,NO 或 NO2 可以完全被吸收并转化为硝酸。工业上生产硝酸,正是基于这一原理。

