摩尔体积公式 物质的量气体体积计算公式
在高中化学中,气体摩尔体积是一个重要概念,它帮助我们理解气体在不同条件下的行为和性质。本文将探讨气体摩尔体积的定义、特点以及影响因素,带领读者深入这一主题。
摩尔体积的定义可以理解为单位物质的量在特定条件下所占据的体积。具体来说,气体摩尔体积(通常用符号vm表示)就是气体体积与其物质的量之比。在化学中,体积的单位是升,而物质的量则以摩尔为单位,因此气体摩尔体积的单位为升每摩尔。
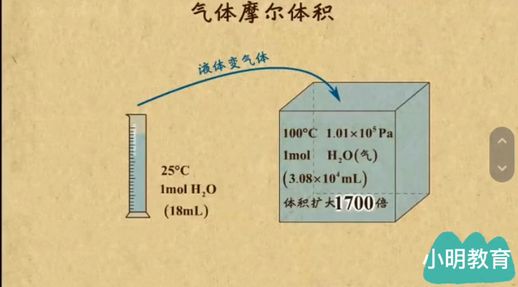
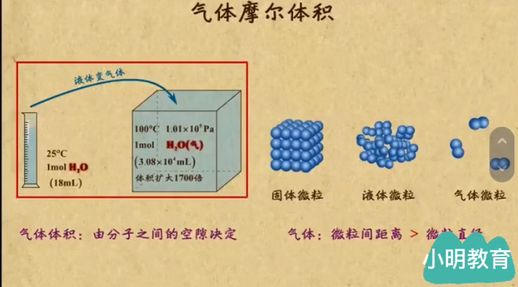
理解了气体摩尔体积的基本概念后,让我们分析其特性。通过实验可以看出,将18毫升的水在100摄氏度和一个大气压下蒸发成水蒸气,体积将扩大到约3080毫升。这一变化说明,气体的体积主要取决于分子间的空隙,而非分子本身的体积。
通过微观视角观察,固体、液体和气体的微粒排列各不相同。固体的微粒紧密排列,液体稍微疏松,而气体的微粒则相隔甚远,几乎形成了大量的空隙。这种特性使得气体的体积大大超过了其成分的体积。
在不同物质之间进行比较,我们可以看到一摩尔氢气、氮气和氧气在一个大气压下的体积均为22.4升,这一数值与固体体积相比,几乎大了上千倍。这表明,在气体状态下,微粒之间的距离是微粒直径的十倍左右。
微观因素决定了物质的体积。对于固体和液体,微粒数目和大小是关键因素;而对于气体,则主要取决于微粒数目和微粒间的距离。在气体中,微粒的体积几乎可以忽略不计。
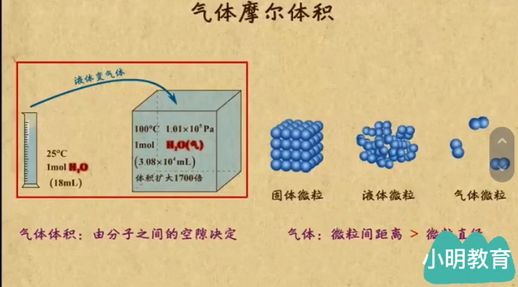
进一步分析,当保持微粒数目不变时,气体体积的大小就取决于微粒间距。气体微粒间距的变化由温度和压强决定:在温度相同的情况下,压强增大,分子间距减小,气体体积也随之减小;反之,压强降低,分子间距增大,体积增加。当温度保持不变,压强相同的情况下,升高温度将导致分子间距增大,体积增大,而降低温度则使其减小。
对于不同的气体,若温度和压强相同,分子数目的不同也会影响气体的体积。根据阿伏伽德罗定律,相同体积的气体在相同条件下,含有相同数目的分子。换句话说,气体的体积比、微粒数比以及物质的量比在相同温度和压强下是相等的。

从数学角度来看,气体在零摄氏度和一个大气压下的摩尔体积接近22.4升。我们可以得出结论,气体的摩尔体积是气体特性的核心,标志着单位物质的量在特定条件下所占据的体积。
气体摩尔体积(vm)是一个关键概念,代表单位物质的量气体的体积,其单位为升每摩尔。在标准状况下,这一值约为22.4升每摩尔。理解这一内容对进一步学习气体性质至关重要。
希望以上的内容能够帮助你更好地掌握气体摩尔体积的知识,接下来可以进行一些相关的练习,以巩固学习成果。
