盐的化学性质 盐与金属的反应
一、酸的基本特性
酸的本质在于其能够在电离时释放出氢离子(H+),形成氢离子和酸根离子的化合物。在化学反应中,酸展现出独特的行为。
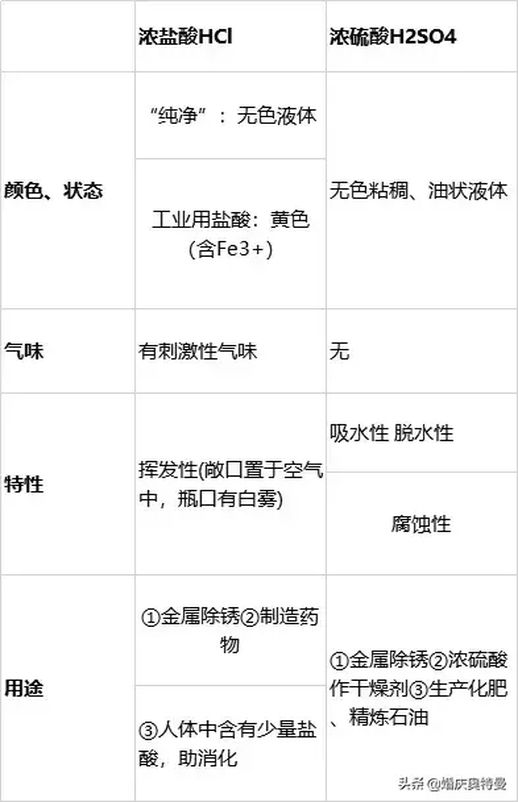
1、浓盐酸与浓硫酸的物理性质及用途
2.酸的普遍性质
酸性溶液会使紫色石蕊试液变红,而无色的酚酞试液则不受影响。在反应过程中,金属与酸反应产生盐和氢气,例如:Zn + 2HCl = ZnCl2 + H↑。类似地,碱性氧化物与酸的反应也会生成盐和水,如:FeO + 6HCl = 2FeCl3 + 3H2O。
对于碱与酸的反应,规则为:金属氢氧化物与酸的结合同样能生成盐和水。盐与酸的反应则可能生成另一种盐和新的酸。
需要注意的是:在“金属 + 酸”反应中,通常使用稀硫酸和稀盐酸,而浓硫酸或浓硝酸因其强氧化性而不适用。金属的活动性顺序同样影响反应的进行,活泼金属可以从酸中置换出氢。
例如,金属活动性顺序为:K > Ca > Na > Mg > Al > Zn > Fe > Sn > Pb > (H) > Cu > Hg > Ag > Pt > Au。在此序列中,越靠前的金属越活泼,反应越快,所需时间越短。
浓硫酸具有强吸水性,因此常用作干燥剂,但在稀释过程中,浓硫酸应缓慢加入水中,以避免因放热反应引发的危险。
二、碱的性质与特点
碱的定义是电离时释放的阴离子皆为氢氧根离子(OH-)。碱通常由金属离子或铵根离子与氢氧根离子组成。
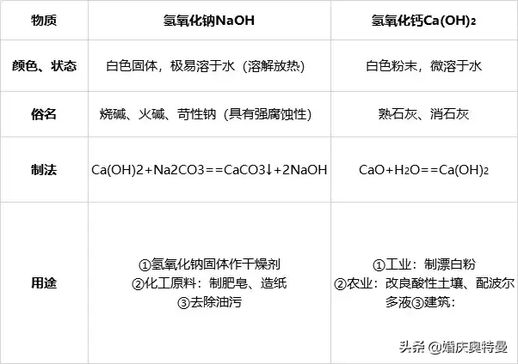
1、氢氧化钠与氢氧化钙的物理性质及用途
2.碱的基本性质
碱性溶液可使紫色石蕊试液变蓝,并使无色酚酞试液变红。氢氧化钠和氢氧化钙在溶液中的表现一致,均使石蕊试液变色。
碱与酸性氧化物的反应同样生成盐和水,例如:2NaOH + CO2 = Na2CO3 + H2O。盐与碱反应时,两者需为可溶性,且生成物中必须有沉淀才能发生反应。
在书写化学方程式时,可先将非金属氧化物与水的反应写出,之后再将生成的含氧酸与碱的反应合并,形成整体方程式。
三、盐的性质与分类
盐的定义是能解离出金属离子或铵根离子与酸根离子的化合物,这里盐的含义并不局限于食盐。
1、盐的提纯过程
精盐的提纯涉及去除不溶性杂质,实验步骤包括溶解、过滤和蒸发。注意在蒸发时,液体体积不应超过蒸发皿的三分之二。
3.盐的化学性质
盐溶液与金属反应时,会产生新的盐和金属,例如:CuSO4 + Zn = ZnSO4 + Cu。盐与酸、碱、盐之间的反应也各有其规律,须遵循金属活动性原则。
四、复分解反应的本质
复分解反应是两种化合物相互交换成分生成两种新化合物的过程,条件是生成的物质需有沉淀、气体或水析出。
五、酸碱盐的溶解性
熟悉酸、碱、盐的溶解性有助于理解其化学反应。常见的可溶性盐有氢氧化钠、氢氧化钙等,而某些盐如硫酸盐和氯化物则存在不溶性限制。
六、离子的检验方法
例如,氯离子(Cl-)可通过加入AgNO3溶液生成白色沉淀来进行检验;硫酸根离子(SO4^2-)可用Ba(NO3)2来确认其存在。类似地,其他离子的检验方法也需根据反应特性进行选择。
七、化合价的记忆法
了解常见元素及原子团的化合价对学习化学至关重要。例如,氢、钾、钠等的正价分别为1,钙、镁等为2。
八、常见物质的俗称与化学式
诸如生石灰(CaO)、食盐(NaCl)等的俗称及其化学式,对学习化学反应和性质具有重要意义。
九、物质颜色的识别
不同物质的颜色特征可用于判断其性质,如蓝色沉淀表示氢氧化铜,红色沉淀可能为铁的氢氧化物等。
化学反应方程式的补充与注意事项

在选择干燥剂时,需根据气体的酸碱性来决定。例如,浓硫酸能有效干燥酸性气体,而氢氧化钠则适合干燥碱性气体。
这篇文章为学习化学的基本知识提供了全面的概述,掌握这些基础将为更深入的研究奠定坚实的基础。
